Что такое гипофосфатемия?
Гипофосфатемия – снижение количества фосфатов в крови. Фосфат является одним из наиболее важных молекулярных строительных блоков для правильного функционирования клеток в организме. Это вещество является важным компонентом нуклеиновых кислот и используется для репликации ДНК и РНК. Он является источником энергии для молекулярных функций благодаря своей роли в образовании аденозинтрифосфата (АТФ). Он добавляет и удаляет фосфатные группы в белках или из них и действует как переключатель включения/выключения для регулирования молекулярной активности. Учитывая его широкую роль почти во всех молекулярных и клеточных функциях, колебания уровня фосфатов в сыворотке могут иметь очень большое влияние.
Гипофосфатемия определяется как концентрация фосфатов в сыворотке крови взрослых менее 2,5 мг/дл (0,81 ммоль/л). Нормальный уровень фосфатов в сыворотке крови у детей значительно выше и составляет у новорожденных 7 мг/дл. Гипофосфатемия является относительно частым лабораторным отклонением и часто является случайным результатом.
Признаки и симптомы
Большинство пациентов с гипофосфатемией не имеют никаких симптомов, и это состояние выявляется случайно. Пациенты с легкой гипофосфатемией могут жаловаться на общую слабость от легкой до умеренной степени. История болезни редко указывает на возможность гипофосфатемии. По этой причине клиницист должен заподозрить аномалии фосфатов всякий раз, когда есть этиология, связанная с гипофосфатемией.
Состояния, при которых может рассматриваться возможность гипофосфатемии, включают: плохое питание, симптомы или анамнез кишечной мальабсорбции, прием антацидов, частые или рецидивирующие боли в костях, переломы, наличие или подозрение на множественную миелому в анамнезе, добавление парентерального питания, прием лекарств, в т.ч. хронические глюкокортикоиды, цисплатин или памидронат и продолжающееся лечение диабетического кетоацидоза,
Умеренная гипофосфатемия клинически не проявляется. Тяжелая гипофосфатемия может проявляться:
- измененное психическое состояние;
- неврологическая нестабильность, включая судороги, и очаговые неврологические симптомы, такие как онемение или снижение рефлексов;
- болезни сердца, в том числе сердечная недостаточность;
- мышечная боль и слабость.
Причины и факторы риска
Гипофосфатемия чаще всего вызывается одной из трех причин:
- недостаточное потребление фосфатов;
- повышенное выделение фосфатов;
- перенос фосфатов из внеклеточного во внутриклеточное пространство.
Эпидемиология
Гипофосфатемия обычно протекает бессимптомно и встречается у 5% пациентов. Гораздо чаще встречается при алкогольной зависимости (алкоголизме), диабетическом кетоацидозе или сепсисе, с частотой до 80%. Частота гипофосфатемии во многом зависит от ее этиологии и тяжести.
Патофизиология
Как упоминалось ранее, наиболее частыми причинами гипофосфатемии являются недостаточное потребление фосфатов, повышенная экскреция фосфатов и перенос фосфатов из внеклеточного пространства во внутриклеточное.
Гипофосфатемия, вторичная по отношению к недостаточному поступлению фосфатов, возникает в условиях длительного отсутствия фосфатов с пищей, нарушения кишечной абсорбции и связывания в кишечнике экзогенными факторами. Почти все диеты содержат избыток фосфатов, достаточный для поддержания нормальных функций организма. Кроме того, адаптация почек обычно может компенсировать краткосрочные дефициты. Нарушение всасывания в кишечнике может быть вызвано различными причинами. В частности, хроническая диарея увеличивает потерю фосфатов через кишечник. Известно, что некоторые лекарства связываются с фосфатом, уменьшая количество доступных свободных ионов, которые всасываются через тонкий кишечник в кровоток. Известно, что антациды и магний связаны с чистой потерей фосфата из организма за счет связывания как с поступившим внутрь, так и с экскретируемым фосфатом.
Увеличение экскреции фосфатов происходит в основном в почечной системе. Проксимальные почечные канальцы поглощают до 70% отфильтрованного фосфата, тогда как дистальные канальцы поглощают до 15% отфильтрованного фосфата. Резорбция регулируется концентрацией фосфатов в сыворотке, при этом умеренное снижение концентрации фосфатов непосредственно запускает повышенную реабсорбцию фосфатов натрий-фосфатными котранспортерами в проксимальных канальцах и увеличивает экспрессию и образование новых натрий-фосфатных котранспортеров. И наоборот, паратиреоидный гормон увеличивает экскрецию фосфатов за счет ингибирования активности натрий-фосфатных котранспортеров. Кроме того, фактор роста фибробластов 23, фактор роста фибробластов 7, фосфогликопротеин внеклеточного матрикса и секретируемый белок, родственный Frizzled-4 (FZ-4), снижают реабсорбцию фосфата натрий-фосфатными котранспортерами.
Наиболее вероятной причиной является первичный или вторичный гиперпаратиреоз, первичный гиперпаратиреоз из-за гиперкальциемии и вторичный гиперпаратиреоз из-за любой из причин дефицита витамина D. Синдромы первичной фосфатной почечной недостаточности также возникают при прямой почечной недостаточности без сопутствующей системной недостаточности. Они включают различные генетические дефекты, которые повреждают котранспортеры фосфата натрия. Одним из наиболее ярких примеров является Х-сцепленная гипофосфатемия, при которой мутация в гене PHEX приводит к повышенным уровням фактора роста фибробластов 23 и непосредственно снижает резорбцию фосфатов в проксимальных отделах почечных собирательных трубочек. Мутации в гене котранспортера фосфата натрия SLC34A3 приводят к нарушению котранспортера фосфата натрия типа 2c. Ген SLC34A1 отвечает за кодирование котранспортера фосфата натрия типа 2а и связан с мутациями. Регулирующий фактор 1 натрий-водородного обменника отвечает за формирование натриевого градиента, обеспечивающего большую часть реабсорбции ионов. Мутации в этой точке приводят к потере пан-иона. Синдром Фанкони — еще одна классическая причина почечной недостаточности. Это генерализованное нарушение функции проксимальных канальцев, приводящее к диурезу, чаще всего вызванное такими заболеваниями, как множественная миелома, при которой легкие цепи иммуноглобулина повреждают почечные канальцы, и болезнь Вильсона-Коновалова с накоплением меди у детей. Все, что увеличивает выработку мочи, также приводит к увеличению потери фосфатов, включая глюкозурию, алкоголь, литий и диуретики, такие как ацетазоламид и тиазиды, быстрое увеличение объема жидкости при пероральном или внутривенном введении.
Внутриклеточная транслокация запасов фосфатов может происходить при различных клинических сценариях. Синдром возобновления питания возникает, когда у больного, страдающего от недоедания, внезапно появляются углеводы, белки и липиды. Инсулин и глюкоза способствуют проникновению фосфатов внутрь клетки. Чистые запасы фосфатов, необходимые для основного метаболизма, такого как гликолиз, истощаются. Организм начинает перерабатывать новые продукты, чтобы производить АТФ для энергии. Клетки поглощают весь доступный свободный фосфат, что приводит к глубокой гипофосфатемии. Синдром голодных костей возникает после коррекции гиперактивности паращитовидной железы, когда остеопенические кости начинают реабсорбировать и накапливать фосфаты и кальций. Это приводит к увеличению потребности костей в этих ионах и к гипофосфатемии. Острый респираторный алкалоз вызывает гипофосфатемию за счет изменения клеточного рН. Повышенный рН стимулирует фосфофруктокиназу, тем самым стимулируя гликолиз с образованием АТФ и таким образом потребляя фосфат из клеточного пространства. Фосфат сыворотки перемещается внутриклеточно, чтобы удовлетворить эту потребность. В целом, тяжелая гипервентиляция с последующим изменением PCO2 до уровня менее 20 мм рт. ст. может снизить уровень фосфатов до уровня менее 0,32 ммоль/л. Считается, что это наиболее частая причина тяжелой стационарной гипофосфатемии.
Диагностка
Гипофосфатемия диагностируется на основании простого измерения в сыворотке крови. Этиология обычно очевидна из анамнеза. Однако, если это неизвестно, следует определить почечную экскрецию фосфатов. Почечная экскреция фосфатов может быть измерена с помощью 24-часового сбора мочи или путем расчета доли отфильтрованной экскреции фосфатов (FEPO4) из случайно выбранной пробы мочи. EPO4 рассчитывается следующим образом, где U — моча, а P — фосфат плазмы (PO4) и креатинин (Cr):
- FEPO4 = (UPO4 x PCr x 100) / (PPO4 x UCr)
24-часовая экскреция фосфатов с мочой менее 100 мг или FEPO4 менее 5% указывает на сниженную экскрецию фосфатов, указывая на то, что гипофосфатемия связана с перераспределением в организме или снижением кишечной абсорбции. Экскреция фосфатов с мочой более 100 мг за 24 часа или FEPO4 более 5% указывает на экскрецию фосфатов почками. Гипофосфатемия в этом сценарии, вероятно, вызвана гиперпаратиреозом или дефицитом витамина D.
Лечение
Следует отменить препараты, снижающие уровень фосфатов.
При легкой гипофосфатемии, не вызывающей симптомов, рекомендуется пить нежирное или обезжиренное молоко с высоким содержанием фосфатов. Вы также можете принимать фосфаты внутрь, но это лечение обычно вызывает диарею.
При очень тяжелых формах гипофосфатемии или если пациент не может принимать фосфаты внутрь, их можно вводить через вену (внутривенно).
Прогноз
Прогноз для излечимой и обычно преходящей причины гипофосфатемии отличный. Прекращение приема антацидов при злоупотреблении антацидами, употребление обычной пищи у пациентов с расстройствами пищевого поведения или паратиреоидэктомия у пациентов с гиперпаратиреозом являются примерами излечимой гипофосфатемии. У больных с острой печеночной недостаточностью гипофосфатемия также связана с хорошим прогнозом, так как может свидетельствовать об использовании клетками фосфора при регенерации гепатоцитов.
Прогноз при синдромах истощения фосфатов также во многом зависит от их причины. Гиперпаратиреоз лечится паратиреоидэктомией. При дефиците витамина D (сочетание мальабсорбции и почечной недостаточности) заместительная терапия витамином D является терапевтической. С другой стороны, гипофосфатемия, сцепленная с Х-хромосомой, и рахит, устойчивый к витамину D, лишь частично поддаются лечению существующими препаратами и приводят к пожизненным деформациям скелета.
Осложнения
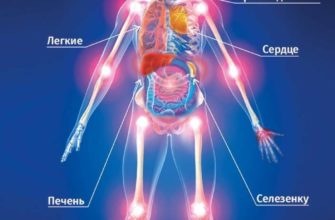
Последствия гипофосфатемии обширны и затрагивают практически все системы. Симптомы этого дефицита проявляются ниже 0,32 ммоль/л. Осложнения в основном связаны с внутриклеточным дефектом, однако могут наблюдаться хронические последствия в костных структурах. Длительная гипофосфатемия приводит к остеопении, остеопорозу, рахиту или остеомаляции из-за снижения минерализации костей. В центральной нервной системе может проявляться метаболическая энцефалопатия из-за истощения АТФ и могут проявляться измененное психическое состояние, раздражительность, парестезия, онемение, судороги или кома. Потеря АТФ влияет на работу сердца. Помимо возможной систолической сердечной недостаточности, миоциты становятся менее стабильными и могут возникать аритмии. Снижение функции диафрагмы влияет на функцию легких с последующей гиповентиляцией. Было показано, что пациенты, зависимые от ИВЛ, имеют более длительное пребывание в больнице и более плохой прогноз с гипофосфатемией. Дисфункция желудочно-кишечного тракта возникает в результате дефицита АТФ, а также может быть дисфагия или кишечная непроходимость.
Возможна общая мышечная слабость. Может возникнуть рабдомиолиз, ведущий к повреждению почек и повышению уровня креатинфосфокиназы, но обычно это наблюдается только при острой или хронической гипофосфатемии, например, у людей, страдающих острым заболеванием, связанным с алкоголем.Заболевание редко бывает гематологическим, но дефицит АТФ может привести к повышению жесткости эритроцитов, предрасположенности к гемолизу, снижению фагоцитоза и лейкоцитарного хемотаксиса гранулоцитов и тромбоцитопении.